PROPHYLAXIE PRÉ-EXPOSITION - mise à jour janvier 2023
PPrE OU PrEP
Qu’est-ce que la PrEP?
La prophylaxie pré-exposition pour le VIH (PPrE) aussi connue sous l’acronyme anglais PrEP est un traitement préventif avec des médicaments antirétroviraux spécifiques pour le VIH. Ces médicaments sont utilisés depuis la fins des années 1990 dans le traitement du VIH. Une fois utilisé chez des personnes VIH négatives, ce traitement préventif diminue grandement le risque d’infection par le VIH. La PrEP réduit la possibilité de contracter le VIH suite à une relation à risque. Cependant, elle n’élimine pas complètement le risque de l’infection par le VIH. On pourrait appeler la PrEP la « pilule contraceptive » contre le VIH.
Quelles sont les molécules utilisées en PrEP?
Les seules molécules approuvées au Canada présentement pour la PrEP sont le Truvada ou son équivalent générique tenofovir disoproxil fumarate (TDF)/ emtricitabine (FTC) 300mg/200mg et Descovy ou tenofovir alafenamide (TAF) 25mg/emtricitabine (FTC) 200mg sans équivalent générique présentement. Les deux médicaments sont utilisés par la voie orale.
L'Organisation mondiale de la santé (OMS) recommande l'utilisation du cabotégravir injectable chez les hommes et les femmes ainsi que l'anneau de dapavirine. L'anneau de dapavirine risque de ne jamais être recommandé au Canada à cause de sa faible efficacité.
Les 3 études de l'anneau de dapavirine donnent des résultats faibles:
Étude « Ring », réduction du risque global de 35 %.
Étude « ASPIRE », réduction du risque global de 27 %.
Étude HOPE (HIV Open-label Prevention Extention) et étude DREAM (Dapavirine Ring Extended Access and Monitoring) une réduction plus importante du risque de plus de 50 %.
Quelle est l'efficacité de la PrEP?
L'efficacité de la PrEP est strictement liée à son adhérence. Pour que la PrEP soit efficace, elle doit être prise régulièrement. Selon de différentes études, l'efficacité de la PrEP peut aller jusqu'à 100% selon étude iPrEx Ole.
Les autres études montrent l'efficacité élevée si prise assidue:
Partners PrEP - en continu, relations hétéro, hommes et femmes, efficacité selon le niveau des médicaments détectés 82%.
PROUD - en continu, HARSAH et femmes trans, efficacité selon le niveau des médicaments détectés 86%.
IPERGAY - à la demande, HARSAH et femmes trans, efficacité selon le décompte des pilules 86%.
IPERGAY Open Label Extension - à la demande, HARSAH et femmes trans, efficacité 97%.
DISCOVER - en continu, HARSAH, femmes trans, efficacité selon le niveau des médicaments détectés 99%.
PRÉVENIR - en continu et à la demande, 50-50, HARSAH et femmes trans, 3 infections dans chaque bras, aucune différence au niveau d'efficacité avec prise en continu versus à la demande, efficacité 99%.
HTPN 083 - injectable, HARSAH et femmes trans, étude terminée précocement à cause de sa supériorité sur TDF/FTC (Truvada générique), efficacité globale non ajustée à la prise du médicament 66%.
HTPN 084 - injectable femmes cis, résultats à venir.
La prise en continu ou à la demande de la PrEP?
Au Canada, seule la PrEP en continu est officiellement approuvée et recommandée. Néanmoins, nous avons 4 études, IPERGAY, IPERGAY Open Label Extension, PRÉVENIR et PROTÈGES, qui démontrent une efficacité élevée. Les études PRÉVENIR et PROTÈGES ne montrent aucune différence en nombre d'infections au VIH dans la prise à la demande versus en continu. La seule molécule officiellement recommandée pour la prise à la demande est le TDF/FTC (Truvada ou son générique). Nous n'avons présentement aucune étude clinique montrant la possibilité de la prise de Descovy (TAF/FTC) à la demande. Cependant, selon la pharmacocinétique, le Descovy (TAF/FTC) devrait avoir la même efficacité à la demande que le TDF/FTC (Truvada ou son générique)
En général, si la personne a, au moins, une relation sexuelle par semaine et cette relation n'est pas anticipée, la prise en continu devrait être favorisée. Si les relations sont anticipées voire prévues et sporadiques, la prise à la demande pourrait être adéquate.
En voyage, seule la PrEP en continu devrait être envisagée puisque les relations sont rarement anticipées ou prévues. Dans la prise de la PrEP à la demande, il faut attendre 2 heures après la prise de 2 comprimés de TDF/FTC pour que la protection soit présente. Les aventures pendant les voyages se passent «ici et maintenant» d'où la prise à la demande serait possiblement inefficace et devrait être découragée.
Quelle est la différence entre le Truvada (TDF/FTC 300mg/200mg) et le Descovy (TAF/FTC 25mg/200mg)?
Les deux médicaments contiennent les mêmes molécules actives qui sont le ténéfovir (TDF ou TAF) et l'emtricitabine (FTC). La différence principale est dans l'absorption du ténofovir par les cellules et les pertes sanguines du ténofovir. Le TDF (tenefovir disoproxil fumarate) contient 300mg du ténofovir. Seulement 10% à 20% du médicament est absorbé et 1e reste est perdu dans la circulation sanguine. Comme le ténofovir est éliminé par les reins, la concentration sanguine élevée du ténofovir peut surcharger les reins et causer une acidose tubulaire proximale connue aussi sous l'appellation du syndrome de Fanconi. En bref, les reins deviennent surchargés et le ténofovir empêche la réabsorption de différentes molécules ou minéraux dans les tubes rénaux causant perte de différentes molécules et minéraux dont le phosphore. Le réservoir naturel du phosphore se situe dans nos os. Quand notre corps détecte une carence en phosphore, il le réabsorbe de nos os ce qui cause la déminéralisation et la fragilité osseuses (ostéopénie / ostéoporose). Le Descovy (TAF/FTC) ne cause pas les mêmes problèmes. Dans le comprimé du Descovy, il n'y que 25mg de ténofovir sous forme de TAF (ténéfovir alaphénamide) donc 90% est absorbé par les cellules donnant environ 10% de pertes sanguines.
Les autres différences entre les deux produits sont:
Truvada ou TDF/FTC ne devrait pas être donné aux personnes avec une fonction rénale diminuée (moins de 50mL/min) ni à ceux avec une fragilité osseuse de base. Le TDF/FTC fut étudié et est indiqué pour la prise en continue chez les hommes et femmes, cis et trans. Le TDF/FTC est aussi indiqué pour la prise à la demande. Par contre, la prise à la demande n'est indiquée que chez les hommes cis et les femmes trans. La prise à la demande n'offre pas la protection chez les femmes cis et ne devrait pas être administrée de cette façon.
L'utilisation de la PrEP chez les personnes avec une hépatite virale de type B chronique devrait être toujours discutée. La prise intermittente (à la demande) est contre-indiquée. Seule la prise en continu devrait être proposée en expliquant au patient qu'en arrêtant le ténofovir, des symptômes d'une hépatite B aiguë pourraient reapparaître. Une prise intermittente risque rendre le virus résistant au ténéfovir. Présentement, le ténofovir est un remède puissant pour traiter cette infection. Le développement d'une résistance à ce médicament pourrait limiter les options thérapeutiques disponibles sur le marché à cause du risque de résistances croisées.
Le Descovy ou TAF/FTC devrait être utilisé avec des précautions chez les personnes qui ont une hypercholestérolémie de base. Il y a des études qui suggèrent qu'il y ait une prise de poids potentielle avec le TAF/FTC. Il est peu probable que le Descovy cause des problèmes rénaux ou une déminéralisation osseuse. Le Descovy n'est pas encore indiqué en PrEP chez les femmes. Son utilisation ne fut étudiée que pour la prise en continu. Il n'y a pas encore de données pour la prise à la demande. Selon la pharmacocinétique du TAF, son utilisation intermittente devrait être aussi efficace qu'avec le TDF. Le Descovy ne devrait pas être utilisé chez des personnes prenant certains anti-épileptiques qui diminuent la concentration du TAF et pourrait rentre la protection inefficace.
Le Truvada (TDF/FTC) et le Descovy (TAF/FTC) n'interagissent ni avec l'alcool ni avec les substances récréatives. Leur prise n'est pas contre-indiquée quoique l'utilisation des deux augmente le risque d'une mauvaise adhérence, de comportements extrêmes et de problèmes de santé physique ainsi que mentale (psychose toxique connue aussi comme bad trip.
La PrEP offre-t-elle une protection absolue contre le VIH?
Non, la PrEP ne donne pas de protection absolue. Si la personne a un contact avec une souche du VIH résistante aux molécules utilisées pour la PrEP, la protection peut être diminuée voire inefficace. Il y a eu quelques cas documentés de transmission du VIH malgré la PrEP prise adéquatement avec des souches résistantes : le cas de Dr J. Fox (BHIVA 2015), le cas de Dr David Knox (CROI 2016) et le cas de Dr Howard Grossman (HIVR4P 2016), le cas de l'étude HTPN 083. Néanmoins, le risque de transmission du VIH avec une souche résistante reste toujours très faible.
Puis-je sauter des doses de la PrEP?
Non, on ne doit pas sauter les doses de la PrEP. Plusieurs études ont démontré un échec substantiel de la PrEP si le médicament n’est pas pris régulièrement. De pauvres adhérences au traitement préventif avec la PrEP dans les études VOICE, FEM-PrEP et ASPIRE ont démontré l’importance de la prise régulière du médicament. La prise de la PrEP telle que prescrite par le professionnel de la santé est cruciale pour avoir une protection adéquate contre le VIH.
La PrEP protège-t-elle contre les autres ITSS ou la grossesse?
Non, la PrEP ne protège aucunement contre les autres infections transmissibles sexuellement et par le sang (ITSS) comme, par exemple, la gonorrhée, la chlamydia, la syphilis ou l’hépatite virale de type C.
À qui devrait-on proposer la PrEP?
La PrEP s’adresse aux personnes séronégatives pour le VIH qui ont un risque substantiel de contracter le VIH, qui ont une bonne fonction rénale (clairance de la créatinine plus grande que 50mL/min) pour le Truvada (TDF/FTC) et 30mL/min pour le Descovy. Auparavant, on recommandait la PrEP juste aux personnes faisant partie d’un des groupes vulnérables d’avoir des relations sexuelles à haut risque pour le VIH:
- les hommes ayant des relations sexuelles avec des hommes (HARSAH)
- les femmes transgenres
- les travailleurs et les travailleuses du sexe
- les utilisateurs de drogues intraveineuses et/ou intra-nasales avec risque de partage de matériel ainsi de contact avec le VIH
- les couples sérodiscordants pour le VIH dont le partenaire séropositif a une charge virale détectable (plus de 40 copies / mL) ou qui ne suit pas le traitement contre le VIH
- les couples sérodiscordants pour le VIH dont le partenaire séropositif pour le VIH vient de commencer le traitement contre le VIH. La PrEP dans ce cas devrait être utilisée pour une durée de 6 mois ou jusqu’au moment où le partenaire VIH positif devienne indétectable (charge virale moins de 40 copies / mL)
Selon la nouvelle mise à jour de CDC (Center of Disease Contrôle) du 2021, la PrEP devrait être donnée à toute personne désirant la commencer après une discussion.
Qui ne devrait pas prendre la PrEP?
- Toute personne vivant déjà avec le VIH
- Toute personne VIH négative qui reste en relation monogame avec une personne vivant avec le VIH traitée, adhérente au traitement et indétectable (CV moins de 40 copies / mL) depuis plus de 6 mois sans autre infection transmissible sexuellement (ITS)
- Toute personne qui pratique toujours des relations sexuelles sécuritaires sans prendre de risques
- Toute personne présentant une réaction allergique à une composante de médicament
Avec qui devrait-on discuter des risques et des bénéfices avant de proposer la PrEP?
- Toute personne ayant une fonctionne rénale diminuée (clairance de la créatinine moins de 60 mL / min) pour ne pas aggraver la condition rénale.
- Toute personne nécessitant un traitement à long terme avec des anti-inflammatoires non stéroïdiens (AINS) comme le naproxen (Naprosyn), celecoxib (Celebrex), ibuprofène (Advil, Motrin), diclofenac (composant d’Artrotec) ou autre puisque les AINS pourraient potentialiser le risque de dommage rénal si pris conjointement avec du TDF / FTC.
- Toute personne vivant avec le virus d’hépatite B devrait discuter avec son médecin des risques et des bénéfices avant de commencer la PrEP. Le TDF dans la PrEP est aussi un des traitements pour le virus d’hépatite B chronique. Une fois la personne vivant avec le virus d’hépatite B commence la PrEP, elle devra la prendre à très long terme voire à vie. Si la PrEP est prise irrégulièrement, le virus d’hépatite B risque de devenir résistant au TDF, un traitement puissant contre cette infection. Si la personne décide d’arrêter ou de suspendre son traitement de la PreP, elle risque de développer des symptômes d’infection d’hépatite B aigüe. De plus, une personne vivant avec le virus d’hépatite B ne devrait jamais prendre de PrEP sur demande mais plutôt en continu.
- Toute personne connue pour de l’ostéopénie ou ostéoporose (diminution de la densité osseuse) ou qui a déjà eu des fractures pathologiques (de fragilité). Le TDF / FTC pourrait aggraver ces conditions en diminuant encore plus la densité osseuse.
- Toute personne avec obésité importante voire morbide. Le TDF / FTC pourrait aggraver l’hépatotoxicité du foie déjà stéatosé (toxicité du foie qui est gras) et causer de l’acidose lactique (débalancement d’équilibre acido-basique) surtout chez les femmes très obèses. L’acidose lactique est une condition médicale urgente pouvant avoir des conséquences très graves incluant la mort.
Qu’est-ce qu’une relation sexuelle à risque?
Toute relation anale ou vaginale sans condom indépendamment de la durée de la pénétration sans protection (quelques secondes ou quelques quarts d’heure) avec une personne considérée à risque pour le VIH (HARSAH, utilisateurs de drogue, personne provenant de région endémiques pour le VIH)
Le risque de transmission du VIH via relation anale per acte sexuel
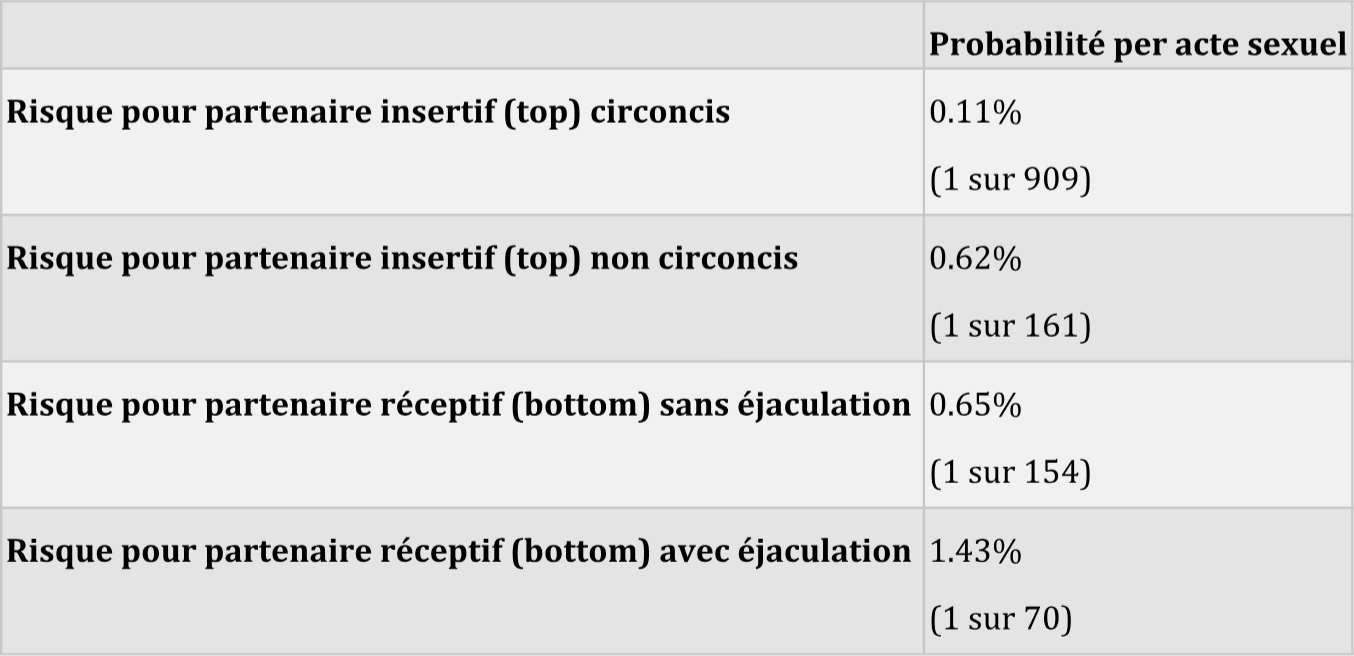
Source: Jin F et al. Per-contact probability of HIV transmission in homosexual men in Sydney in the era of HAART.
AIDS, Publié en ligne avant impression, 2010.
Est-ce que le sexe oral ou le fait de « doigter » quelqu’un est aussi à risque pour le VIH?
Quant au sexe oral, le cunnilingus (bouche-vagin), l’anilingus (bouche-anus) et la fellation insertive (mettre le pénis dans la bouche de l’autre personne) portent un risque théorique de transmission du VIH (fortement improbable) sans aucun cas documenté dans la littérature.
Quant à la fellation réceptive (prendre le pénis dans la bouche), le risque de transmission du VIH est plus que théorique surtout si éjaculation dans la bouche avec ulcération ou abrasions dans la cavité buccale post procédures dentaires (brossage de dents ou soie dentaire). Néanmoins, il n’y a pas d’évidence définitive concernant ces facteurs. Le risque de transmission orale du VIH par la fellation insertive reste toujours moindre que toutes les autres formes de relations sexuelles. Le faible risque de transmission du VIH par fellation insertive est contribué à l’activité inhibitrice du VIH par des enzymes salivaires, le faible taux de sel dans la salive, une moindre susceptibilité au VIH du tissu de la cavité buccale et l’activité virucide des enzymes digestives de l’estomac.
Le fait de « doigter » quelqu’un porte uniquement un risque théorique (fortement improbable) même s’il y a des abrasions cutanées. Aucun cas n’a été documenté de cette forme de transmission dans la littérature.
Quel est le médicament utilisé pour la PrEP?
Le seul médicament approuvé présentement pour la PrEP est le fumarate de ténofovir dispoproxil (TDF) conjointement avec l’emtricitabine (FTC) aussi connu sous le nom commercial de Truvada.
D’autres molécules sont présentement étudiées pour l’utilisation de la PrEP comme le ténofovir alafénamide (TAF) conjointement avec l’emtricitabine (FTC) connu sous le nom commercial de Descovy. Cette molécule est étudiée présentement dans l’étude Discover et démontre une très bonne protection contre le VIH selon les données préliminaires. L’avantage de cette molécule est la prise du médicament avec une clairance de la créatinine diminuée même jusqu’à 30 millilitres par minute. Le Descovy présente aussi un moindre risque d’effet rénal ou osseux que le TDF / FTC.
D’autres molécules comme le maraviroc, le ténofovir intravaginal (étude CAPRISA) ou l’anneau vaginal de dapiravine (étude ASPIRE) sont aussi étudiées.
Quels sont les effets indésirables et / ou graves avec la prise de la PreP?
Les effets secondaires à court terme peuvent être des nausées, vomissements, crampes abdominales, étourdissements, céphalées et fatigue. Ces symptômes commencent d’habitudes dans les deux premières semaines de la prise du TDF / FTC et ne dure qu’une à deux semaines. Souvent la prise du médicament avec de la nourriture va diminuer les symptômes gastro-intestinaux. La prise du TDF / FTC au coucher diminue les symptômes de la fatigue.
Les effets secondaires à long terme et graves incluent l’acidose tubulaire proximale (syndrome de Fanconi) et la déminéralisation osseuse (ostéoporose / ostéopénie).
Le syndrome de Fanconi se caractérise par un défaut de réabsorption avec une fuite urinaire de protéines, de glucose, de phosphate, d’acides aminés, de bicarbonates et d’autres composés organiques. Il survient dans moins de 5 pourcents de cas et est réversible en grande majorité en arrêtant le TDF / FTC. Il y a eu des cas très rares d’insuffisance rénale grave nécessitant des greffes rénales.
Le risque du syndrome de Fanconi peut être augmenté chez
- les personnes âgées
- les personnes de race noire ou asiatique
- les autochtones
- les personnes obèses
- les fumeurs
- les personnes atteintes du diabète sucré
- les personnes coinfectées avec le virus d’hépatite C
- les personnes souffrant d’hypertension artérielle, de dyslipidémie ou de maladiecardiovasculaire
- les personnes avec les calculs rénaux (pierres rénales) ou infections rénales
- les personnes avec l’anémie falciforme
- les personnes vivantes avec des conditions auto-immunes comme le lupus par exemple
- les personnes avec l’histoire familiale de la maladie rénale
Le risque de l’ostéoporose ou de l’ostéopénie peut être augmenté chez
- les femmes
- les personnes âgées
- les personnes de race blanche ou asiatiques
- les personnes avec l’histoire familiale de l’ostéoporose ou de fractures de fragilité
- les personnes de petits poids ou soufrant d’anorexie
- les personnes avec débalancements hormonaux tels que l’hypothyroïdie, l’hypotestostéronémie (testostérone basse) ou l’hypo-estrogénie (estrogène basse)
- les personnes fumeuses, abusant de l’alcool, sous méthadone / opiacés ouinactives physiquement
- les personnes avec carence en vitamine D et / ou calcium
- les personnes avec la prise à long terme de la cortisone
- les personnes vivant avec le VIH, le diabète sucré, les infections chroniques, la maladie rénale chronique ou prenant certains médicaments comme les anticoagulants, anticonvulsivants, antipsychotiques, cyclosporines, glitazones, inhibiteurs de pompes à proton ou le méthotrexate.
Quelles sont les interactions médicamenteuses de la PrEP avec les autresmédicaments?
Il n’y a pas d’interactions significatives de la PrEP avec les autres médicaments sauf pour certains traitements pour le virus d’hépatite C et les inhibiteurs SGLT2 dans le traitement du diabète.
FTC peut avoir une interaction avec orlistat (médicament pour la perte du poids) en altérant l’absorption d’orlistat.
TDF peut augmenter le risque de néphrotoxicité si combiné avec des inhibiteurs SGLT2 comme canagliflozin (Invokana), dapagliflozin (ForxigaTM), empagliflozin (JardianceTM). La fonction rénale doit être suivi de prêt.
Le Liverpool HIV drug interaction website (Site d’interactions médicamenteuses de VIH de Liverpool) permet de vérifier les interactions avec les autres médicaments. Le site est accessible au
Comment devrait-on prendre la PrEP?
PrEP en continu
Le TDF / FTC devrait être débutée 7 jours avant la première relation à risque pour les hommes et 21 jours pour les femmes, prise quotidiennement et si décision d’arrêt de la PrEP, elle devrait être continuée au moins 2 à 28 jours après la dernière relation.
PrEP en continu c’est la méthode la plus fiable présentement avec de multiples études confirmant son efficacité jusqu’à 100% si bonne adhérence au traitement (études IPREX, IPREX Ole, PROUD, parteners PrEP, parteners demonstration project, Bangkok TDF, TDF 2 et deux études en cours présentement DISCOVER et PROTÈGE)
La PrEP en continu ne devrait pas être prise si la personne nécessite des traitements à long terme avec des anti-inflammatoires non stéroïdiens (AINS) comme le naproxen (Naprosyn), celecoxib (Celebrex), ibuprofène (Advil, Motrin), diclofenac (composant d’Artrotec) ou autre.
PrEP sur demande
2 comprimés de TDF / FTC devraient être pris entre 2 heures et 24 heures avant la relation sexuelle et 1 comprimé devrait être pris le premier et le deuxième jour après la relation sexuelle.
Cette méthode fut étudiée juste chez des hommes ayant des relations sexuelles avec des hommes (HARSAH). Elle n’est pas conseillée pour des femmes et des utilisateurs de drogues intraveineuses ou intranasales.
La PrEP sur demande ne devrait pas être prise chez les gens vivant avec l’hépatite virale chronique de type B.
La limitation de cette étude est qu’elle fut testée par une seule étude appelée IPERGAY en France conjointement avec le Québec. L’efficacité établie de la PrEP sur demande fut à 86%. Une deuxième étude appelée PROTÈGE teste aussi l’efficacité de cette méthode; néanmoins, les résultats finaux ne sont pas encore disponibles. Les résultats préliminaires semblent très prometteurs pour la prise sur demande de la PrEP.
PrEP en vacances
Certaines personnes se protègent toujours quand elles sont chez elles mais en voyage, elles prennent des risques. La PrEP peut être considérée si des risques sont anticipés à court terme.
La prise quotidienne de la PrEP peut être effectuée 7 jours avant le voyage, tout au long du voyage et 7 jours après le voyage. (La prise de la PrEP après la dernière relation sexuelle à risque devrait avoir lieu au minimum 2 jours après et au maximum 28 jours après). La PrEP le 7 jours avant, tout au long du voyage et 7 jours après est une recommandation non publiée mais en concordance avec les recommandations québécoises et canadiennes.
Pourquoi utiliser TDF / FTC en association pour la PrEP?
Les propriétés biologiques du FTC et TDF en font des agents de première génération attrayants pour la PrEP:
- Activité antirétrovirale puissante contre la plupart des sous-types du VIH avec une barrière de résistance élevée
- Peu de cas de transmission de souches résistantes au TDF / FTC
- Activité tôt dans le cycle de vie du VIH
- Longue demi-vie intracellulaire, capable d’atteindre des concentrations élevées dans le tractus génital
- Dosage uni quotidien pratique et peu d’interactions médicamenteuses
- Profil d’innocuité établi d’après leur utilisation en association comme traitement antirétroviral (TAR)
Quel est le suivi de la PrEP?
Le suivi de la PrEP doit être fait 1 mois après l’instauration du traitement de la prophylaxie pré-exposition et puis à chaque trois mois avec les tests tel que suggéré dans les lignes directrices canadiennes et / ou québécoises.
Lignes directrices canadiennes pour la PrEP et PPE
Lisez le document sur le site officiel canadien.